- Gerar link
- X
- Outros aplicativos
TOGEOMETRIA GRACELI DE CATEGORIAS NO SDCTIE GRACELI, NO SISTEMA TENSOR G+ GRACELI, E SISTEMA INFINITO-DIMENSIONAL .
ENVOLVENDO TENSOR G+, SDCTIE GRACELI, E O INFINITO-DIMENSIONAL. EM ESTADOS FÍSICOS, QUÃNTICO, QUÍMICO, CONFIGURAÇÃO ELETRÔNICA, ENRGIAS E NÍVEIS DE ENERGIAS DOS ELEMENTOS QUÍMICO E ÁTOMOS, CATEGORIAS FENOMÊNICAS E ESTRUTURAIS POTENCIAIS, E OUTROS.
A TOPOGEOMETRIA GRACELI TAMBÉM ABRANGE AS CATEGORIAS DE GRACELI, SUAS DIMENSÕES, E SEUS ESTADOS FÍSICOS, ESTRUTURAIS.
, COMO TAMBÉM:
SISTEMA GRACELI INFINITO-DIMENSIONAL = sdctie graceli, sistema de infinitas dimensões +
SISTEMA DE TENSOR G+ GRACELI , ESTADOS FÍSICOS -QUÍMICO-FENOMÊNICO DE GRACELI CATEGORIAS E Configuração eletrônica dos elementos químicos
SISTEMA GRACELI INFINITO-DIMENSIONAL.
SISTEMA GRACELI INFINITO-DIMENSIONAL.
COM ELEMENTOS DO SISTEMA SDCTIE GRACELI, TENSOR G+ GRACELI CAMPOS E ENERGIA, E ENERGIA, E CONFIGURAÇÕES ELETRÔNICAS DOS ELEMENTOS QUÍMICO, E OUTRAS ESTRUTURAS.
ESTADO E NÚMERO QUÂNTICO, NÍVEIS DE ENERGIA DO ÁTOMO, FREQUÊNCIA. E OUTROS.
TENSOR G+ GRACELI, SDCTIE GRACELI, DENSIDADE DE CARGA E DISTRIBUIÇÃO ELETRÔNICA, NÍVEIS DE ENERGIA, NÚMERO E ESTADO QUÂNTICO. + POTENCIAL DE SALTO QUÂNTICO RELATIVO AOS ELEMENTOS QUÍMICO COM O SEU RESPECTIVO E ESPECÍFICO NÍVEL DE ENERGIA.
SISTEMA MULTIDIMENSIONAL GRACELI
ONDE A CONFIGURAÇÃO ELETRÔNICA TAMBÉM PASSA A SER DIMENSÕES FÍSICO-QUÍMICA DE GRACELI.
Configuração eletrônica dos elementos químicos.
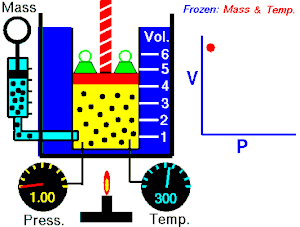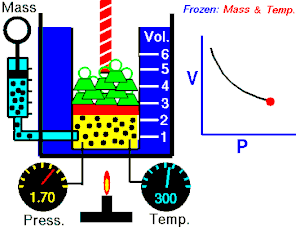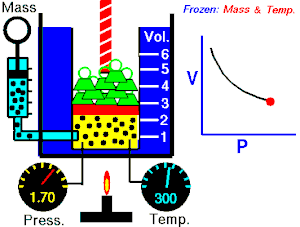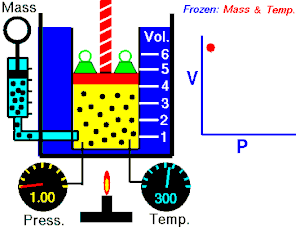
Lei de Boyle-Mariotte
| Mecânica do contínuo |
|---|
 |
Leis[Expandir] |
Cientistas[Expandir] |
Lei de Boyle-Mariotte (geralmente citada somente como Lei de Boyle) enuncia que a pressão absoluta e o volume de uma certa quantidade de gás confinado são inversamente proporcionais se a temperatura permanece constante em um sistema fechado.[1][2] Em outras palavras, ela afirma que o produto da pressão e do volume é uma constante para uma devida massa de gás confinado enquanto a temperatura for constante. A lei recebe o nome de Robert Boyle, que a publicou em 1662,[3] e de Edme Mariotte, que posteriormente realizou o mesmo experimento e o publicou na França, em 1676, sem ter tido conhecimento dos trabalhos de Boyle.
Segundo a lei enunciada pelos dois cientistas: em um gráfico pressão x volume, sob uma temperatura constante, o produto entre pressão e volume deveria ser constante, se o gás fosse perfeito. Existe uma temperatura em que o gás real aparentemente obedece à lei de Boyle-Mariotte. Esta temperatura é chamada de temperatura de Mariotte.
História
A relação entre pressão e volume foi primeiramente observada por dois cientistas amadores, Richard Towneley e Henry Power. Boyle confirmou a descoberta de ambos e publicou os resultados. De acordo com Robert Gunther e outras autoridades foi Robert Hooke, assistente de Boyle, quem construiu os aparelhos para os experimentos. As leis de Boyle são baseadas em experimentos com ar, que ele considerou ser um fluido de partículas em repouso entre pequenas molas invisíveis. Naquela época, ar ainda era considerado como um dos quatro elementos dos alquimistas, embora Boyle discordasse. O interesse de Boyle era provavelmente compreender o ar como um elemento essencial da vida;[4] por exemplo, ele publicou trabalhos sobre o crescimento de plantas sem ar.[5] O físico francês Edme Mariotte (1620–1684) descobriu a mesma lei independentemente de Boyle em 1676, embora Boyle já houvesse publicado os dados em 1662. Portanto esta lei referida como Lei de Boyle-Mariotte ou simplesmente como Lei de Mariotte. Mais tarde, em 1687, na Philosophiæ Naturalis Principia Mathematica, Newton exibiu matematicamente que, se um fluido elástico constituído de partículas em repouso, entre as quais existem forças repulsivas inversamente proporcionais à sua distância, a densidade será diretamente proporcional à pressão,[6] mas esta prova matemática não é a explicação física para a relação observada. Ao invés de uma teoria estática, é necessária uma teoria cinética que foi fornecida dois séculos depois por Maxwell e Boltzmann.
Definição
A lei pode ser definida da seguinte forma:
Para uma quantidade fixa de um gás ideal mantido a uma temperatura constante, a pressão P e o volume V são inversamente proporcionais (enquanto um dobra, o outro fica a metade).[2]
Relação para teoria cinética e os gases ideais
A lei de Boyle-Mariotte afirma que à temperatura constante para uma quantidade fixa de massa, a pressão absoluta e o volume de um gás são inversamente proporcionais. A lei também pode ser definida de uma maneira um pouco diferente: que o produto entre volume e pressão é sempre constante.
A maioria dos gases se comporta como gases ideais a pressões e temperaturas moderadas. A tecnologia do século XVII não podia produzir pressões altas ou temperaturas muito baixas. Portanto, a lei não aparentava ter limitações no momento da publicação. Conforme avanços tecnológicos permitiam pressões maiores e temperaturas menores, desvios do comportamento de gás ideal tornaram-se notáveis, e a relação entre pressão e volume somente pode ser descrita com precisão utilizando-se a teoria do gás ideal.[7] O desvio é relacionado com o coeficiente de compressibilidade.
Robert Boyle (e Edme Mariotte) obtiveram a lei somente de forma experimental. A lei pode ser obtida também de forma teórica baseada na existência de átomos e moléculas e assumindo colisões perfeitamente elásticas (veja teoria cinética dos gases). No entanto estas suposições eram vistas com enorme resistência entre a comunidade científica positivista da época, sendo vistas somente como construções puramente teóricas para as quais não havia a menor evidência observacional.
Daniel Bernoulli em 1737–1738 deduziu a lei de Boyle-Mariotte utilizando as leis de Newton com aplicação a nível molecular. Ela permaneceu ignorada até por volta de 1845, quando John Waterston realizou uma publicação construindo os maiores princípios da teoria cinética; este foi rejeitado pela Royal Society. Posteriormente trabalhos de James Prescott Joule, Rudolf Clausius e em particular de Ludwig Boltzmann estabeleceram firmemente a teoria cinética dos gases e trouxe o foco para ambas as teorias de Bernoulli e Waterston.[8]
O debate entre defensores do energética e atomismo levaram Boltzmann a escrever um livro em 1898, que enfrentou criticas até o seu suicídio em 1906.[8] Albert Einstein, em 1905, mostrou como a teoria cinética se aplicava ao movimento browniano de uma partícula de fluido suspenso, que foi confirmada em 1908 por Jean Perrin.[8]
Equação
A equação matemática da lei de Boyle-Mariotte é:
- ///////////////////////////////////////////////////////////////////////////////////////////
SISTEMA GRACELI INFINITO-DIMENSIONAL = sdctie graceli, sistema de infinitas dimensões +
SISTEMA DE TENSOR G+ GRACELI , ESTADOS FÍSICOS -QUÍMICO-FENOMÊNICO DE GRACELI CATEGORIAS E Configuração eletrônica dos elementos químicos
SISTEMA GRACELI INFINITO-DIMENSIONAL.
onde:
Enquanto a temperatura permanecer constante a mesma quantidade de energia permanece através da operação e portanto, teoricamente, o valor de k permanecerá constante. No entanto, devido a derivação da pressão como força perpendicular aplicada e a probabilística probabilidade de colisão com outras partículas através da teoria das colisões, a aplicação de força a uma superfície pode não ser infinitamente constante para certos valores de k, mas terá um limite quando tais valores são diferenciados em um dado tempo.
Forçando a aumentar o volume V de uma quantidade fixa de gás, mantendo o gás a temperatura inicial, a pressão P deve diminuir proporcionalmente. Reciprocamente, reduzir o volume do gás aumenta a pressão.
A lei de Boyle é usada para prever o resultado de se introduzir uma mudança, somente de volume ou pressão, a um estado inicial de uma quantidade fixa de gás. O volume e a pressão antes e depois da quantidade fixa de gás, onde as temperaturas antes e depois são iguais (aquecimento ou resfriamento serão necessários para alcançar essas condições), estão relacionadas pela equação:
- ///////////////////////////////////////////////////////////////////////////////////////////
SISTEMA GRACELI INFINITO-DIMENSIONAL = sdctie graceli, sistema de infinitas dimensões +
SISTEMA DE TENSOR G+ GRACELI , ESTADOS FÍSICOS -QUÍMICO-FENOMÊNICO DE GRACELI CATEGORIAS E Configuração eletrônica dos elementos químicos
SISTEMA GRACELI INFINITO-DIMENSIONAL.
Aqui, 



As lei de Boyle, lei de Charles, e lei de Gay-Lussac formam, juntamente com a lei de Avogadro, a lei dos gases ideais.
A Lei de Charles é uma lei dos gases perfeitos. Esta lei diz respeito às transformações isobáricas, isto é, aquelas que se processam a pressão constante, cujo enunciado é o seguinte:
À pressão constante, o volume de uma determinada massa de gás é diretamente proporcional à sua temperatura absoluta.[1]
essa relação de proporcionalidade pode ser descrita como:
- ///////////////////////////////////////////////////////////////////////////////////////////
SISTEMA GRACELI INFINITO-DIMENSIONAL = sdctie graceli, sistema de infinitas dimensões +
SISTEMA DE TENSOR G+ GRACELI , ESTADOS FÍSICOS -QUÍMICO-FENOMÊNICO DE GRACELI CATEGORIAS E Configuração eletrônica dos elementos químicos
Jacques Charles observou, em 1787, que todos os gases têm aproximadamente o mesmo coeficiente de dilatação volumétrica β ≈ 1/273 °C-1.
Isto, em 1802, foi verificado experimentalmente com maior precisão por Joseph Gay-Lussac. O valor atualmente aceito é:
- ///////////////////////////////////////////////////////////////////////////////////////////
SISTEMA GRACELI INFINITO-DIMENSIONAL = sdctie graceli, sistema de infinitas dimensões +
SISTEMA DE TENSOR G+ GRACELI , ESTADOS FÍSICOS -QUÍMICO-FENOMÊNICO DE GRACELI CATEGORIAS E Configuração eletrônica dos elementos químicos
Logo, sabendo da equação de dilatação volumétrica descrita por
,
- ///////////////////////////////////////////////////////////////////////////////////////////
SISTEMA GRACELI INFINITO-DIMENSIONAL = sdctie graceli, sistema de infinitas dimensões +
SISTEMA DE TENSOR G+ GRACELI , ESTADOS FÍSICOS -QUÍMICO-FENOMÊNICO DE GRACELI CATEGORIAS E Configuração eletrônica dos elementos químicos
onde:
- β é o coeficiente de dilatação volumétrica
- V0 é o volume do gás correspondente a 0 °C
- V é o volume do gás à temperatura ΔT na escala Celsius
- T0 = 273,15 K
- T = ΔT + 273,15 K, sempre à pressão constante P = 1 atm.
Assim, podemos manipular algebricamente a equação acima:
SISTEMA GRACELI INFINITO-DIMENSIONAL = sdctie graceli, sistema de infinitas dimensões +
SISTEMA DE TENSOR G+ GRACELI , ESTADOS FÍSICOS -QUÍMICO-FENOMÊNICO DE GRACELI CATEGORIAS E Configuração eletrônica dos elementos químicos
Como β ≈ 1/273 °C-1, podemos substituir na equação acima e continuar com a operação algébrica:
- ///////////////////////////////////////////////////////////////////////////////////////////
SISTEMA GRACELI INFINITO-DIMENSIONAL = sdctie graceli, sistema de infinitas dimensões +
SISTEMA DE TENSOR G+ GRACELI , ESTADOS FÍSICOS -QUÍMICO-FENOMÊNICO DE GRACELI CATEGORIAS E Configuração eletrônica dos elementos químicos
- ///////////////////////////////////////////////////////////////////////////////////////////
SISTEMA GRACELI INFINITO-DIMENSIONAL = sdctie graceli, sistema de infinitas dimensões +
SISTEMA DE TENSOR G+ GRACELI , ESTADOS FÍSICOS -QUÍMICO-FENOMÊNICO DE GRACELI CATEGORIAS E Configuração eletrônica dos elementos químicos
Assim como definido anteriormente, T0 = 273,15 K e T = ΔT + 273,15 K e sendo ΔT a temperatura final do gás na escala Celsius:
- ///////////////////////////////////////////////////////////////////////////////////////////
SISTEMA GRACELI INFINITO-DIMENSIONAL = sdctie graceli, sistema de infinitas dimensões +
SISTEMA DE TENSOR G+ GRACELI , ESTADOS FÍSICOS -QUÍMICO-FENOMÊNICO DE GRACELI CATEGORIAS E Configuração eletrônica dos elementos químicos
Desta maneira, aumentando a temperatura de um gás a pressão constante, o seu volume aumenta, e diminuindo a temperatura, o volume também diminui. Teoricamente, ao cessar a agitação térmica das moléculas, a pressão é nula, e atinge-se o zero absoluto, ou seja, o volume tende a zero.
A representação gráfica da transformação isobárica, no gráfico do volume pela temperatura absoluta, é uma reta.
Lei de Gay-Lussac refere-se a diferentes leis nomeadas em homenagem ao cientista francês Joseph Louis Gay-Lussac (1778-1850) e que tratam das propriedades dos gases. As leis de Gay-Lussac se aplicam tanto quimicamente, quanto fisicamente no comportamento dos gases.
1ª Lei: Proporções Volumétricas
O estudo da transformação isovolumétrica (abaixo), resultou na Lei Volumétrica de Gay-Lussac. É também conhecida pela lei da combinação de volumes ou lei das proporções volumétricas constantes, e é utilizada, em maior parte, no ramo da química. Tem relação com o estudo dos volumes dos gases que participam de uma reação química. Tem o seguinte enunciado:
"Gases nas mesmas condições de pressão e temperatura, seus volumes mantém-se em proporções fixas."
Os valores dos volumes em uma reação química são diferentes dos valores matemáticos.
Em relação a transformação volumétrica, a lei de Gay-Lussac diz, em resumo, além da proporção volumétrica dos gases, quando medidos na mesma temperatura e pressão, serem constantes, há também uma razão de números inteiros, em geral pequenos, existente entre os volumes dos gases reagente e os produtos da reação química.
2ª Lei: Transformação Isovolumétrica
É também conhecida por isocórica[1] ou isomérica, e ocorre quando o volume de um dado gás permanece constante, mas com variações de temperatura que acarretam em variações de pressão. Também relaciona o volume de substâncias gasosas antes e depois da ocorrência de reações químicas. Tem o seguinte enunciado:
"Para uma certa massa fixa de gás, com seu volume constante, sua pressão é diretamente proporcional à sua temperatura."
- Tem-se então a relação:
- ///////////////////////////////////////////////////////////////////////////////////////////
SISTEMA GRACELI INFINITO-DIMENSIONAL = sdctie graceli, sistema de infinitas dimensões +
SISTEMA DE TENSOR G+ GRACELI , ESTADOS FÍSICOS -QUÍMICO-FENOMÊNICO DE GRACELI CATEGORIAS E Configuração eletrônica dos elementos químicos
onde:
é a pressão do gas.
é a temperatura termodinâmica.
é uma constante.
Portanto para comparar a mesma substância em estados diferentes (estando de acordo com as condições acima) afirma-se que:
- ///////////////////////////////////////////////////////////////////////////////////////////
SISTEMA GRACELI INFINITO-DIMENSIONAL = sdctie graceli, sistema de infinitas dimensões +
SISTEMA DE TENSOR G+ GRACELI , ESTADOS FÍSICOS -QUÍMICO-FENOMÊNICO DE GRACELI CATEGORIAS E Configuração eletrônica dos elementos químicos
Em uma transformação isovolumétrica, o aumento da pressão do gás ocorre devido ao aumento das colisões entre moléculas, quando a temperatura aumenta. Esse efeito pode ser notado, por exemplo, nos pneus de borracha, pois quando a sua temperatura aumenta, a pressão no interior dos pneus também se eleva. Daí então a importância da calibragem regular dos pneus, a fim de regular os níveis de pressão.
Essa relação entre variáveis foi publicada em 1802, baseada no estudo desenvolvido cerca de 20 anos antes pelo também francês Jacques Charles, à quem foi atribuída a descoberta da relação entre temperatura e volume de um certo gás, com pressão constante, conhecida por '''Lei de Charles''. Devido a essa semelhança, é comumente encontrado na literatura a nomenclatura "Lei de Gay-Lussac e Charles".A semelhança entre leis também permitiu que Gay-Lussac e Lord Kelvin estabelecessem o valor de zero absoluto de temperatura, resultando assim na criação da escala Kelvin.[2]
3ª Lei: Transformação Isobárica
É uma das leis das transformações gasosas, cujo enunciado diz:
"Em uma transformação isobárica, para uma certa massa gasosa, volume e temperatura são diretamente proporcionais."
Obtendo, assim, a seguinte relação:
SISTEMA GRACELI INFINITO-DIMENSIONAL = sdctie graceli, sistema de infinitas dimensões +
SISTEMA DE TENSOR G+ GRACELI , ESTADOS FÍSICOS -QUÍMICO-FENOMÊNICO DE GRACELI CATEGORIAS E Configuração eletrônica dos elementos químicos
Para a compreensão da Lei de Gay-Lussac, considere um gás em um recipiente com uma tampa que seja móvel. Dessa forma, se aquece o gás, deixando a tampa livre. Com o aumento da temperatura, é possível notar a expansão do gás, resultando na elevação da tampa e, em consequência, o aumento do volume. Então, se a temperatura aumenta, o volume também deve aumentar. E vice-versa. Para que a pressão permaneça constante.
Consequências da Lei de Avogadro
A hipótese de Avogadro de que volumes iguais de gases diferentes, nas mesmas condições de pressão e temperatura, contêm o mesmo número de partículas levaram à determinação da constante de Avogadro (6,022 x 1023)
Por exemplo, se enchermos um balão com gás Hélio (He), teremos o volume de 22,4 litros e 6,022 x 1023 moléculas de gás. Entretanto, se enchermos o mesmo balão até que ele ocupe o mesmo volume com outro gás, o hidrogênio (H2), por exemplo, teríamos a mesma quantidade de moléculas.
A mais significante consequência da Lei de Avogadro é que a constante dos gases tem o mesmo valor para todos os gases.[3] Isso significa que:
- ///////////////////////////////////////////////////////////////////////////////////////////
SISTEMA GRACELI INFINITO-DIMENSIONAL = sdctie graceli, sistema de infinitas dimensões +
SISTEMA DE TENSOR G+ GRACELI , ESTADOS FÍSICOS -QUÍMICO-FENOMÊNICO DE GRACELI CATEGORIAS E Configuração eletrônica dos elementos químicos
Onde:
- p é a pressão do gás no recipiente
- T é a temperatura em kelvin do gás
Lei de Boyle-Mariotte
Para uma dada temperatura, o produto da pressão exercida por uma quantidade de gás e o volume por ele ocupado é constante:
- ///////////////////////////////////////////////////////////////////////////////////////////
SISTEMA GRACELI INFINITO-DIMENSIONAL = sdctie graceli, sistema de infinitas dimensões +
SISTEMA DE TENSOR G+ GRACELI , ESTADOS FÍSICOS -QUÍMICO-FENOMÊNICO DE GRACELI CATEGORIAS E Configuração eletrônica dos elementos químicos
Aqui 



Lei de Charles
ou
- ///////////////////////////////////////////////////////////////////////////////////////////
SISTEMA GRACELI INFINITO-DIMENSIONAL = sdctie graceli, sistema de infinitas dimensões +
SISTEMA DE TENSOR G+ GRACELI , ESTADOS FÍSICOS -QUÍMICO-FENOMÊNICO DE GRACELI CATEGORIAS E Configuração eletrônica dos elementos químicos
A uma pressão dada, o volume ocupado por uma certa quantidade de um gás é diretamente proporcional a sua temperatura.
Lei dos Gases Ideais
A lei de Boyle, Lei de Charles, e Lei de Gay-Lussac formam, juntamente com a lei de Avogadro-Ampère, a lei dos gases ideais.
- ///////////////////////////////////////////////////////////////////////////////////////////
SISTEMA GRACELI INFINITO-DIMENSIONAL = sdctie graceli, sistema de infinitas dimensões +
SISTEMA DE TENSOR G+ GRACELI , ESTADOS FÍSICOS -QUÍMICO-FENOMÊNICO DE GRACELI CATEGORIAS E Configuração eletrônica dos elementos químicos
A lei das pressões parciais (Lei de Dalton) pode ser entendida através do modelo de Dalton para uma mistura ideal, no qual se assume a premissa de que cada um dos componentes de uma dada mistura existe separadamente e independentemente, ocupando todo o volume e estando em equilíbrio térmico com o restante da mistura. Neste modelo o comportamento de um dado componente não é influenciado pela presença dos demais, e assim podemos estudar o dado elemento separadamente. Uma vez que neste modelo se assume que cada elemento ocupa todo o volume disponível, a pressão total da mistura será composta pela soma das pressões parciais de cada elemento que constitui a mistura.
Pode-se resumir a lei de Dalton na seguinte forma:
"Numa mistura gasosa ideal de n componentes, o comportamento de cada componente é independente dos demais, e cada uma ocupa todo o volume disponível, implicando que a pressão total (
) seja igual à soma das pressões parciais (
) de cada componente".
Para que esse modelo seja válido, o potencial químico entre os componentes da mistura deve ser desprezível e deve-se garantir condições de baixa temperatura e pressão (CNTP - Condições Normais de emperatura e Pressão), vale ressaltar que esse modelo corresponde a termodinâmica clássica portanto se relaciona essencialmente a situações de equilíbrio termodinâmico, para mais informações pode-se consultar o livro Fundamentos da Termodinâmica Clássica[1].
- ///////////////////////////////////////////////////////////////////////////////////////////
SISTEMA GRACELI INFINITO-DIMENSIONAL = sdctie graceli, sistema de infinitas dimensões +
SISTEMA DE TENSOR G+ GRACELI , ESTADOS FÍSICOS -QUÍMICO-FENOMÊNICO DE GRACELI CATEGORIAS E Configuração eletrônica dos elementos químicos
A Lei de Proust ou a Lei das Proporções Definidas foi elaborada no ano de 1797 pelo químico francês Joseph Louis Proust. Ele verificou que as massas dos reagentes e as massas dos produtos que participam da reação obedecem sempre a uma proporção constante. Essa proporção é característica de cada reação, isto é, independente da quantidade de reagentes utilizados.
Assim, para a reação entre, por exemplo, hidrogênio e oxigênio formando hidróxido de hidrogênio, os seguintes valores experimentais podem ser obtidos:
Hidrogênio (g) Oxigênio (g) Hidróxido de hidrogênio (g) 4 32 36 8 64 72 1 8 9 - ///////////////////////////////////////////////////////////////////////////////////////////
SISTEMA GRACELI INFINITO-DIMENSIONAL = sdctie graceli, sistema de infinitas dimensões +
SISTEMA DE TENSOR G+ GRACELI , ESTADOS FÍSICOS -QUÍMICO-FENOMÊNICO DE GRACELI CATEGORIAS E Configuração eletrônica dos elementos químicos
- ///////////////////////////////////////////////////////////////////////////////////////////
SISTEMA GRACELI INFINITO-DIMENSIONAL = sdctie graceli, sistema de infinitas dimensões +
SISTEMA DE TENSOR G+ GRACELI , ESTADOS FÍSICOS -QUÍMICO-FENOMÊNICO DE GRACELI CATEGORIAS E Configuração eletrônica dos elementos químicos
Observe que, para cada reação, a massa do produto é igual à soma da massa dos reagentes, o que concorda com a Lei de Lavoisier.
As massas dos reagentes e dos produtos que participam de uma reação podem ser diferentes, mas as relações entre elas são sempre constantes.
Leis Ponderais: São leis que estabelecem relações entre as massas das substâncias que participam das reações quimicas No exemplo da água:
| mO/mH | mágua/mH | mágua/mO |
|---|---|---|
| 80/10 = 8 | 90/10 = 9 | 90/80 = 1,125 |
| 16/2 = 8 | 18/2 = 9 | 18/16 = 1,125 |
| 8/1 = 8 | 9/1 = 9 | 9/8 = 1,125 |
| 3,2/0,4 = 8 | 3,6/0,4 = 9 | 3,6/3,2 = 1 |
No caso das reações de síntese (aquelas que originam uma substância a partir de seus elementos constituintes), o enunciado da lei de Proust é :
"A massa final de um recipiente fechado, após ocorrer dentro dele uma reação química, é sempre igual a massa inicial."
Essa lei foi, mais tarde, a base para a teoria atômica de Dalton, que a fortalece.
Lei de Richter-Wenzel ou Lei das Proporções Recíprocas:
"A massa de dois elementos que se combinam separadamente com a mesma massa de um elemento, são as mesmas, suas múltiplas ou submúltiplas, com que eles se combinam entre si, caso isso seja possível ". " Quando a massa fixa de um elemento se combina com massas variáveis de outros elementos para formar diferentes compostos, se estes elementos se combinam entre si, combinar-se-ão segundo estas mesmas massas, ou múltiplas, ou submúltiplas ". ou esta " A proporção em massa das substâncias que reagem e que são produzidas numa reação é fixa, constante e invariável."
- Gerar link
- X
- Outros aplicativos



















Comentários
Postar um comentário